Gelenkknorpel ist essentiell für die Funktion der Gelenke. Kommt es zu einem Verlust desselben, ist ein Ersatz schwierig, aufwendig und langwierig. Knorpelforscher wollen das ändern.
Immer mehr Patientinnen und Patienten leiden unter Problemen, weil ihre Gelenke eine defekte Knorpelschicht aufweisen. In jungen Jahren sind es oft Traumata, die den Knorpel verletzen. Bei Älteren sind Abnutzungserscheinungen wie die Arthrose typisch. Ist der Knorpel erst einmal abgenutzt, gibt es verschiedene Möglichkeiten, ihn neu aufzubauen. Auch wenn dies immer ein komplizierter Prozess ist, soll der komplette Gelenkersatz so lange wie möglich vermieden werden.
Knorpel ist ein besonderes Gewebe. In dünnen Schichten überzieht er die Gelenkfl ächen unserer Knochen und sorgt auf diese Weise dafür, dass sie auch unter hoher Belastung annähernd reibungslos aneinander vorbeigleiten. Knorpel ist so aufgebaut, dass sich zwischen den einzelnen Knorpelzellen die sogenannte extrazelluläre Matrix befindet, die sich stark vereinfacht aus Wasser und diversen Eiweißen zusammensetzt. „Dieses Konstrukt verleiht dem Knorpel zusammen mit den Zellen die Robustheit gegen Zug- und Scherkräfte“, erklärt Priv.-Doz. Dr. med. Björn Rath, Leitender Oberarzt an der Klinik für Orthopädie der Uniklinik RWTH Aachen. „Dabei wird der Knorpel nicht durchblutet. Die Versorgung des Knorpels erfolgt durch Diffusion, also durch den passiven Transport von Molekülen von Orten höherer zu solchen mit niedriger Konzentration aus der Gelenkflüssigkeit. Sich selbst erneuern kann Knorpel nicht, das heißt, er besitzt keine Selbstheilungskräfte.“
In der Klinik für Orthopädie der Uniklinik RWTH Aachen werden verschiedene Methoden zur Therapie von Knorpelschäden verfolgt. Ein völliger Gelenkersatz soll immer erst die letzte aller Möglichkeiten sein.
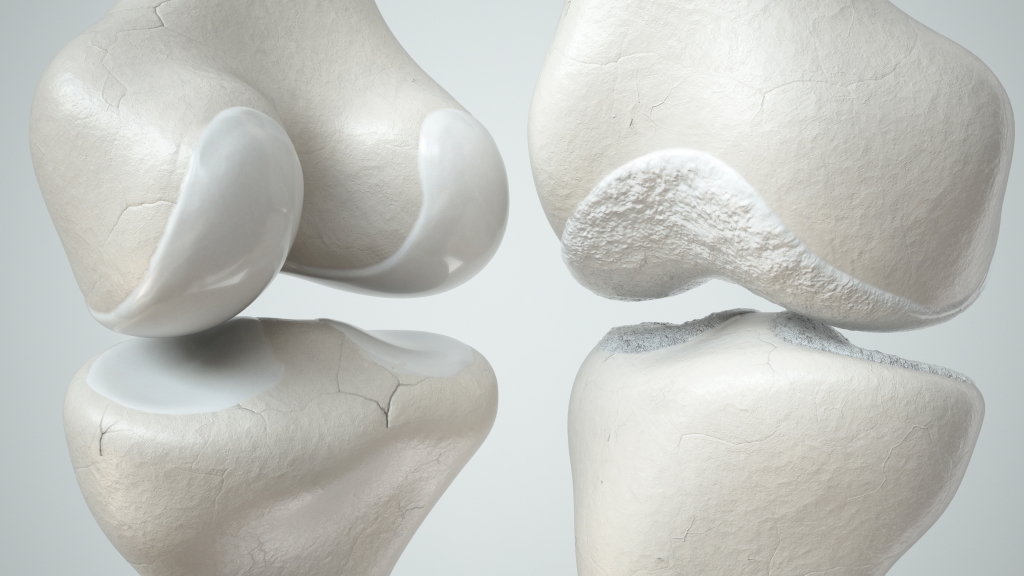
links: Kniemodell mit gesundem Knorpel; rechts: Kniemodell mit abgenutztem Knorpel (Foto: © crevis / Fotolia)
Eine Methode ist die sogenannte Nanofrakturierung. Hier wird der Körper dazu gebracht, selbst Ersatzknorpel zu bilden. Dafür werden in einer arthroskopischen Operation (Schlüssellochtechnik) in der Knorpeldefektzone zahlreiche tiefe Löcher mit geringem Durchmesser gesetzt, man erzeugt gewünschte Mikroblutungen. Durch diese haarfeinen Risse und minimalen Durchbrüche kommt es zum Austreten von Knochenmarkstammzellen. Entwicklungsfähige Zellen aus dem Blut setzen sich fest. Innerhalb von zwei bis drei Monaten wandelt sich der Blutkuchen in Faserknorpel um. Dieser füllt nach und nach den Knorpeldefekt auf. „Auf diese Weise kann der geschädigte Bereich wieder überdeckt werden“, sagt Dr. Rath. „Der Patient ist schmerzfrei und kann sich wieder normal bewegen.“
Eine etablierte Therapie, um auch größere Verletzungen zu heilen, ist die Anzucht von gesundem Knorpelgewebe im Labor, die sogenannte Autologe Chondrozyten Transplantation, kurz ACT. „Dafür wird bei einer ersten Operation gesunder Knorpel entnommen“, erklärt der Experte weiter. „Dieser Knorpel wird aus Bereichen im Kniegelenk gewonnen, die keiner oder nur einer geringen Belastung ausgesetzt sind.“ Aus diesen Bereichen wird ein rund fünf Millimeter großes Stück ausgestanzt und im Labor auf einem Trägergewebe oder als Zellgemisch, der sogenannten Matrix, vermehrt. Nach rund vier Wochen wird ein zweiter Eingriff angesetzt und das neue Gewebe an den defekten Stellen implantiert.
Als Alternative zur Knorpelzelltransplantation kann bei reinen Knorpelschäden mit einem großen Durchmesser die Technik der Autogenen Matrix-induzierten Chondrogenese, kurz AMIC, eingesetzt werden. Bei dieser Technik wird nach Präparation des Knorpelschadens zunächst eine reguläre Mikrofrakturierung im Knochen des Defektes angelegt. Um den einwandernden Zellen ein Gerüst zu geben, in welches diese einwachsen können, und um eine gewisse Primärstabilität zu bieten, wird der aufbereitete Knorpelschaden mithilfe einer Kollagen-basierten Membran (dreidimensionale Matrix) abgedeckt. Diese wird vor der Applikation genau auf die Größe des Schadens zugeschnitten und dann an den gesunden Knorpel angenäht beziehungsweise angeklebt. Neben der Funktion als Gerüst und Stabilisator soll die Membran die Entwicklung der Stammzellen in Richtung Knorpelzellen fördern. Diese Operationsmethode kann je nach Lage und Größe des Defektes ebenfalls arthroskopisch oder über eine minimal-offene Operation am Gelenk durchgeführt werden.
Um die Therapiemöglichkeiten und Erfolge weiter voranzutreiben, beschäftigt die Klinik für Orthopädie eine eigene Forschergruppe mit der Knorpelforschung. „Neben der Untersuchung von etablierten Therapiemethoden im Hinblick auf deren weitere Optimierung wird parallel auch an dem Verständnis der zellulären Zusammenhänge von Knorpel geforscht“, erklärt Dr.-Ing. Jörg Eschweiler, Forschungs- und Laborleiter der Klinik für Orthopädie. Hierzu wurde an der Aachener Uniklinik ein spezieller Bioreaktor entwickelt, der es erlaubt, gezüchtete Knorpelzellen Belastungstests zu unterziehen. Ziel ist es, zellbiologische und biochemische Veränderungen, die sich im Laufe einer Arthrose und auch im Rahmen der Knorpelreparation im Knorpel ereignen, zu untersuchen und zu verstehen. Zudem liegt der Fokus auf der Entwicklung neuer Zellträger, die eine physiologischere Form haben, was ein Einwachsen von Knorpelzellen verbessert und erleichtert.

Dr.-Ing. Jörg Eschweiler, Forschungs- und Laborleiter, Klinik für Orthopädie

Priv.-Doz. Dr. med. Björn Rath, Leitender Oberarzt und stellv. Klinikdirektor, Klinik für Orthopädie
In Kooperation mit der Klinik für Interventionelle und Diagnostische Radiologie der Uniklinik RWTH Aachen liegen die Schwerpunkte bei der Knorpeldiagnostik auf der Evaluation neuer Sequenztechniken für die unterschiedlichen Gelenke, etwa Kniegelenk oder Hüftgelenk. Denn oftmals kann der Grad der Arthrose selbst im Magnetresonanztomographen nur schwer eingeschätzt werden. Die Knorpelprojekte beschäftigen sich vor allem mit der quantitativen Diagnostik degenerativer Veränderungen, beispielsweise im Rahmen der Diagnostik von Knorpeldefekten. ![]()