Schwere chronische Schmerzsyndrome wie die erbliche Erythromelalgie (IEM) sind für Betroffene ein belastendes Schicksal, da die Krankheit nicht geheilt und der Schmerz kaum gelindert werden kann. Eine aktuelle Studie der Forschungsgruppe unter Leitung von Prof. Dr. med. Angelika Lampert aus dem Institut für Physiologie an der Uniklinik RWTH Aachen zeigt, welche Rolle ein einzelnes Protein in dieser Krankheit spielt, und warum bisher entwickelte Schmerzmedikamente nicht wirken. Zum ersten Mal wurden dazu entscheidende Erkenntnisse aus menschlichen Neuronen gewonnen. Die Ergebnisse erscheinen in PAIN, dem renommierten Journal für Schmerzforschung.
Die erbliche Erythromelalgie (IEM) ist eine Erkrankung der Nerven des Körpers, die zu extremen, brennenden Schmerzen in den Extremitäten führt. Betroffene beschreiben die Schmerzen häufig so, als ob glühende Lava über ihre Extremitäten gegossen würde. Da erhältliche Schmerzmedikamente meist kaum Wirkung zeigen, wissen sich Patienten oft nicht anders zu helfen als durch Kühlung der betroffenen Region in Eiswasser. Doch das führt häufig zu Hautschäden und weiteren Problemen.
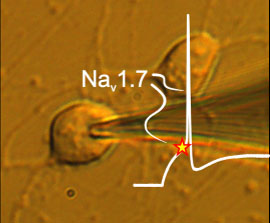
Die wegweisende Studie der Forschungsgruppe um Prof. Lampert hat durch Messungen an stammzell-abgeleiteten Neuronen die Rolle eines bestimmten Proteins bei der Schmerzentstehung in menschlichen Neuronen entschlüsselt. Dieses Protein ist der spannungsgesteuerte Natrium-Kanal (Nav) 1.7.
Die Aachener Forscher konnten in diesem Kooperationsprojekt mit den Gruppen von Prof. Dr. rer. nat. Martin Zenke, RWTH Aachen und Prof. Dr. med. Beate Winner, Universität Erlangen-Nürnberg, zeigen, dass dieser Kanal die Aktivierungsschwelle der peripheren Neurone definiert. Durch Mutationen, die zu IEM führen, ist der Kanal so verändert, dass er die Aktivierungsschwelle der Neuronen herabsenkt: „Bei Nervenzellen von unseren Schmerzpatienten zeigen sich deutlich früher Aktionspotentiale – das bedeutet, dass diese Nervenzellen weitaus empfindlicher sind und bereits auf sehr schwache Reize reagieren“, erklärt Dr. Jannis Meents, Erstautor der Studie.
Mittels eines Spinnentoxins konnten die Forscher zeigen, dass die Inhibition – also die Blockierung des Kanals – vermutlich keine Lösung des Problems darstellt. Dies würde auch erklären, warum bisherige Schmerzmedikamente in klinischen Studien erfolglos geblieben sind. „Um neue Schmerztherapien zu testen, standen bisher nur Zellen von Nagetieren zur Verfügung. Mit den Stammzell-abgeleiteten Nervenzellen von Patienten stellen wir nun ein menschliches System zur Verfügung, das die Entwicklung neuer, besserer Medikamente hoffentlich wesentlich unterstützen wird“, so Prof. Lampert. Ihre Arbeitsgruppe am Institut für Physiologie der Uniklinik RWTH Aachen forscht im Bereich der Neurophysiologie und interessiert sich insbesondere für die molekularen Grundlagen der peripheren Schmerzentstehung. ![]()
Die Studie „The role of Nav1.7 in human nociceptors: insights from human iPS cell-derived sensory neurons of erythromelalgia patients” ist auch online erschienen: https://journals.lww.com/pain/Abstract/publishahead/The_role_of_Nav1_7_in_human_nociceptors__insights.98752.aspx
Ein Video zu diesen Untersuchungen ist hier zu finden: https://youtu.be/MhrGCY6aKDA