Die Forschungsaktivitäten auf dem Gebiet der Mechanobiologie an der Uniklinik RWTH Aachen setzen eine Tradition fort, die mit einem der Wegbereiter der Medizinischen Fakultät in Aachen, dem Orthopäden Professor Friedrich Pauwels (1885-1980), eng verbunden ist. Ihm gelang es, eine Brücke zu schlagen zwischen der Biomechanik, die sich vornehmlich mit den Kräften, der Anatomie und Physiologie des Bewegungsapparats beschäftigt, und der Mechanobiologie, die die zellulären und molekularen Reaktionen auf mechanische Kräfte untersucht. So wies er auf die Fähigkeit von unreifen Zellen hin, in Abhängigkeit von den auf sie einwirkenden mechanischen Kräften Zug, Druck und Scherung in unterschiedliche Zellarten zu differenzieren. Diese Reaktionen implizieren, dass Zellen in der Lage sind, mechanische Kräfte wahrzunehmen und auf diese gezielt zu reagieren. Die gegenwärtige weltweite Begeisterung für die Mechanobiologie beruht auf der Tatsache, dass genetische Programme durch mechanische Signale initiiert und korrigiert werden können. So bestimmt die Steifigkeit der Matrix, ob aus einer Stammzelle eine Fett-, Muskel- oder Knochenzelle entsteht, und sie bestimmt auch, wie und wohin sich Zellen bewegen. Mechanische Signale stellen sicher, dass sich Zellverbände – Gewebe – korrekt entwickeln und spezifische Funktionen zuverlässig erfüllen. Fehlsteuerungen dieser Prozesse führen zu krankhaften Veränderungen, etwa Tumore, Organdefekte oder Fehlanlagen. Die molekularen Mechanismen dieser erstaunlichen Reaktionen sind bisher nur unvollständig verstanden. In diesem Spannungsfeld liegen die Forschungen auf dem Gebiet der Mechanobiologie an der RWTH Aachen. Ziel ist, lokale Kräfte mit maximaler räumlicher und zeitlicher Auflösung in vitalen Zellen und Geweben zu messen und zu applizieren. Festgestellt werden soll, wie Kräfte zelluläres Verhalten im Gewebekontext beeinflussen, um letztendlich krankheitsverursachende Fehlsteuerungen zu korrigieren und die Erkenntnisse gezielt in der Herstellung von funktionellem Gewebeersatz einzusetzen. Die enge Kooperation von Wissenschaftlerinnen und Wissenschaftlern der Ingenieur-, Material- und Lebenswissen-schaften, der Biophysik sowie klinisch tätigen Ärztinnen und Ärzten bietet hierfür einen idealen Nährboden, siehe Bild 1.

Bild 1: Mechanobiologische Eigenschaften von Gewebeverbänden werden mit aufwendigen Visualisierungsverfahren sichtbar gemacht. Die Ergebnisse müssen in interdisziplinären Teams diskutiert und kritisch bewertet werden. (Foto: Peter Winandy)
Der native Gewebezusammenhang wird in komplexen Zellkulturmodellen nachgestellt, um unter standardisierten und präzise steuerbaren Laborbedingungen physiologische und pathologische mechanobiologische Prozesse zu untersuchen. In diesen Ko-Kultur-Modellen von verschiedenen Zellen wird der Einfluss von lokal applizierten Kräften und der umgebenden Matrix auf das Zellverhalten mikroskopisch und biochemisch dargestellt. So kann analysiert werden, wie Kräfte in Raum und Zeit die Funktion und Dysfunktion von Zellen und Geweben beeinflussen und welche klinischen Konsequenzen sich daraus ergeben.
Bild 2 zeigt Beispiele aktueller Forschungsprojekte. Es verdeutlicht, dass mechanische Kräfte eine zentrale Bedeutung für alle Gewebe haben, und dokumentiert die Sichtweise, dass sich jede Zelle in einer einzigartigen mikromechanischen Nische befindet. Diese wird bestimmt von den Kräften, die die Zellen selbst generieren – Kontraktion, Migration und Steifigkeit –, von Kräften, die von der Umgebung auf die Zellen einwirken – Kopplung an Nachbarzellen und die umgebende extrazelluläre Matrix, Bewegung von Organen, Muskelkontraktion –, und von Kräften, die von außen auf den Organismus wirken – Druck auf die Fußsohle beim Gehen, Kompressionsstrümpfe, isostatischer Druck beim Tauchen, Verletzung. Die Berücksichtigung der unterschiedlichen Parameter bedingt eine enorme Komplexität an wissenschaftlichen Fragestellungen, die vielfältige Zellprozesse und Funktionen betreffen. ![]()
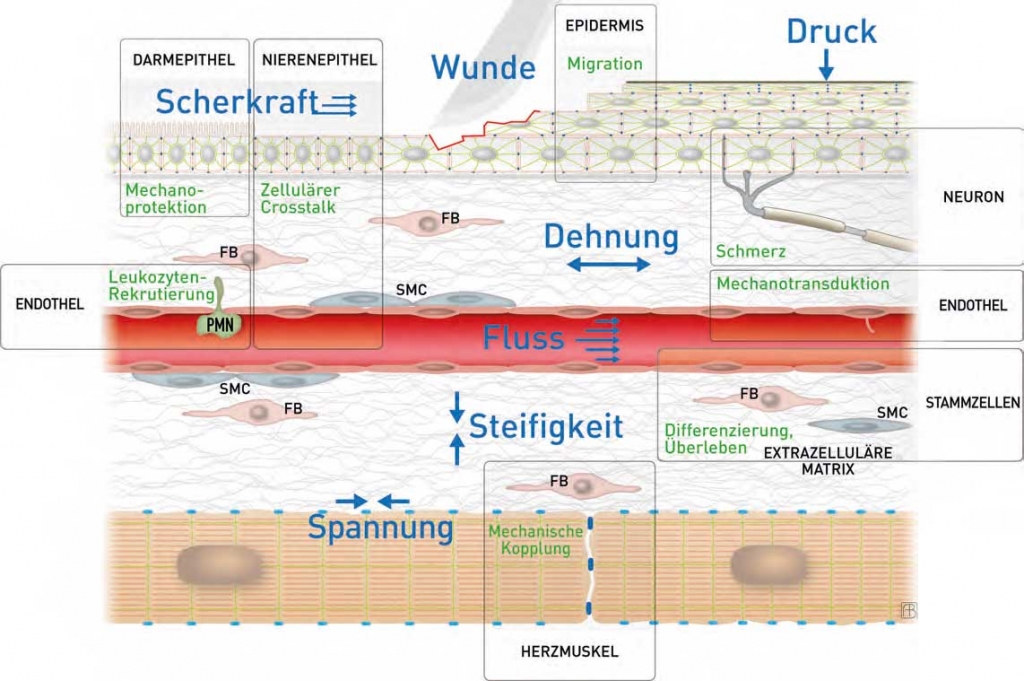
Bild 2: Zusammenstellung von Forschungsprojekten, die den Einfluss von mechanischen Faktoren auf verschiedene Zelltypen untersuchen. Dargestellt sind ein- und mehrschichtige Oberflä-chenepithelien, darunter gelegenes Bindegewebe mit kollagenen Fasern, Fibroblasten (FB), glatten Muskelzellen (SMC) und Nervenendigungen, ein von Endothelzellen und glatten Muskelzellen umgebenes Blutgefäß und kontraktile Herzmuskelzellen. Die gezeigten mechanischen Reize umfassen Verletzung, Druck, Scherkräfte, Dehnung, Blutfluss, Steifigkeit der extrazellulären Matrix und durch zelluläre Kontraktion ausgelöste Spannung. Die Reaktionen schließen mechanoprotektive Effekte, interzellulären Signalaustausch (Crosstalk), Migration von Keratinozyten in der verletzten Epidermis und von Leukozyten (PMN) durch die Blutgefäßwandung, Schmerzinduktion, Mechanoperzeption und -transduktion, Differenzierung von Stammzellen und mechanische Kopplung ein.
Den vollständigen Artikel sowie Quellennachweise und Autorenlisten finden Sie im Forschungsmagazin RWTH THEMEN.