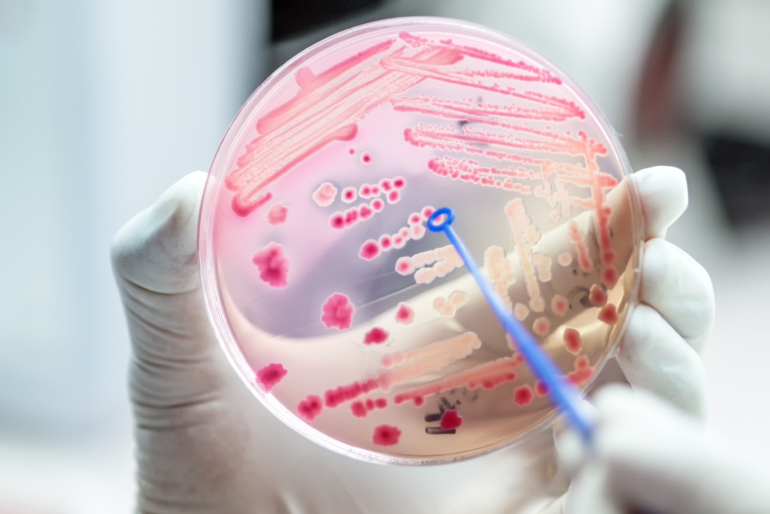
Antibiotikaresistenzen nehmen weltweit weiterhin zu. Die Maßnahmen, um dieser Entwicklung zu begegnen, sind bekannt, doch der Faktor menschliches Verhalten bleibt eines der größten Probleme. Expertinnen und Experten fordern daher eine bessere Aufklärung und Sensibilisierung des medizinischen Personals, um einen gezielteren Einsatz der verfügbaren Antibiotika zu erreichen.
Antibiotika sind im Kampf gegen Bakterien eine wahre Wunderwaffe. Die Medikamente sind in der Lage, das Wachstum von Bakterien zu hemmen oder sie abzutöten – bakterielle Infektionen können so besiegt werden. Doch die Menschheit läuft Gefahr, durch einen falschen und zu häufigen Einsatz das entdeckte Wundermittel zu verspielen, denn immer mehr Resistenzen treten bei den unterschiedlichsten Bakterien auf. Die mögliche Folge wäre, dass die vorhandenen Antibiotika nicht mehr wirken: Fachleute sprechen von dem Problem der antimikrobiellen Resistenzen (AMR) und beobachten diese Entwicklung mit großer Sorge. Schon seit Längerem warnt auch die Weltgesundheitsorganisation (WHO) vor einem Zustand, indem die wichtigste Waffe im Kampf gegen Bakterien – Antibiotika – eines Tages wirkungslos sein könnte. In vielen Teilen der Welt könnten jetzt behandelbare Erkrankungen wieder lebensbedrohlich werden, denn die Probleme sind global unterschiedlich verteilt: Nach statistischen Schätzungen der Global Burden of Disease Study, veröffentlich in der Fachzeitschrift The Lancet, sind im Jahr 2019 schon etwa 1,27 Millionen Menschen verstorben, weil die eingesetzten Antibiotika nicht mehr gewirkt haben – AMR ist damit eine der häufigsten Todesursachen. Die Forschenden gehen davon aus, dass bei rund 4,95 Millionen Menschen Antibiotikaresistenzen für den Tod mit verantwortlich waren. Besonders betroffen von diesem Phänomen sind ärmere Regionen wie Subsahara-Afrika oder Südasien. In Ländern mit einem höheren Einkommen sind die Effekte deutlich niedriger – in nordeuropäischen Staaten wie Deutschland ist das Problem bisher am wenigsten stark ausgeprägt.
Falscher Umgang befördert Antibiotikaresistenzen
Das Ausmaß der Probleme hängt ursächlich mit dem breiten Einsatz der Antiinfektiva zusammen. Eine falsche oder zu häufige Nutzung befördert Resistenzen – die Bakterien werden unempfindlich gegenüber dem Medikament. Forschende müssen daher neue Wirkstoffe entwickeln, die über einen anderen Mechanismus versuchen, das Wachstum zu hemmen oder das Bakterium abzutöten. „In vielen Ländern, wie zum Beispiel Indien, gibt es beispielsweise keine Rezeptpflicht für Antibiotika. Der Verwendung der Medikamente findet dann oft ohne ärztliche Begutachtung statt. Zudem wird gerade in Schwellenländern oft eine sogenannte empirische Therapie bei Infektionskrankheiten angewendet“, erklärt Prof. Dr. med. Sebastian W. Lemmen, Leiter des Zentralbereichs für Krankenhaushygiene und Infektiologie der Uniklinik RWTH Aachen. Darunter versteht man, dass zur Behandlung der Erkrankung breit wirksame Antibiotika eingesetzt werden, ohne dass zuvor versucht wird, den Erreger zu bestimmen und eine Empfindlichkeitsprüfung durchzuführen. Auch während der begonnenen Behandlung wird eine Identifizierung nicht angestrebt, um gegebenenfalls nachzusteuern. „Jeder Arzt sollte aber vor der Verschreibung eines Antibiotikums abwägen, ob der Patient sie wirklich braucht, und sich die Folgen dieser Routine-Medikation für die Allgemeinheit bewusst machen. Würden solche Medikamente seltener und in geringerer Menge verordnet, ließe der Selektionsdruck auf die Bakterien nach, der resistente Stämme begünstigt. Wir kennen allerdings auch hierzulande immer noch für zu wenige Infektionskrankheiten die sicher ausreichende minimale Dosierung und Behandlungsdauer. Auf diesem Gebiet ist noch viel intensive klinische Forschung notwendig“, sagt Prof. Lemmen.
Anzahl hochresistenter Bakterienstämme nimmt zu
Die WHO führt seit Längerem eine Prioritätenliste, auf der mittlerweile zwölf resistente Bakterien verzeichnet sind, gegen die es unbedingt wirksame Antibiotika zu entwickeln gilt. Es gäbe zwar bereits etliche Kandidaten, aber keiner davon werde in absehbarer Zeit zur Verfügung stehen. Zudem betreffe auch keiner die drei Bakterien, die die meisten Todesfälle verursachen: Acinetobacter baumannii, Pseudomonas aeruginosa und bestimmte Erreger aus der Gruppe der Enterobacteriaceae. Auf dem G7-Treffen im vergangenen Mai nahmen sich die Staatschefs vor, „die stille Pandemie von Antibiotikaresistenzen mit allen Kräften zu bekämpfen.“ Sie wollen daher die Forschung und Entwicklung neuer Antibiotika stärker vorantreiben und bis Ende 2023 nationale Ziele festlegen, um den sachgerechten Einsatz vorhandener Antibiotika zu fördern. Deutschland hat bereits im Jahr 2008 nationale Ziele in der Deutschen Antibiotika-Resistenzstrategie (DART) festgelegt, die für die Human- als auch für die Veterinärmedizin gültig sind. Neben der sachgerechteren Verwendung der Medikamente verfolgt die Strategie das Ziel, auf einen konsequenteren Einsatz der Infektionshygiene hinzuwirken. Eine erste Evaluation im Jahr 2020 zeigte bereits, dass die Maßnahmen im Bündel wirksam sind und durchaus Erfolge erzielen. „Entscheidend ist das Zusammenspiel von Surveillance – also die systematische kontinuierliche Überwachung von Erkrankungen und Sterberaten in der Bevölkerung, ein sachgerechter Antibiotikaeinsatz, eine Infektionsprävention, eine Stärkung der Aus- und Weiterbildung des medizinischen Personals sowie eine konsequente Förderung der Forschung und Entwicklung. Nur wenn wir alle Aspekte beachten, sind die nationalen Ziele und eine Verbesserung der Lage erreichbar“, meint Prof. Lemmen. Derzeit arbeitet man an der Weiterentwicklung der Strategie – DART 2030 soll die bisherigen Erfolge aufgreifen und ausbauen.
Verbesserte Qualifizierung des medizinischen Personals
Expertinnen und Experten meinen, dass Deutschland sich grundsätzlich noch in einer vergleichsweise guten Situation und auf dem richtigen Weg befinde. Bisher komme es nur selten vor, dass Ärztinnen und Ärzte eine bakterielle Infektion nicht mehr in den Griff bekommen. Doch dieser Zustand ist nicht automatisch gesichert: Denn es steigt die Anzahl der Patientinnen und Patienten in Krankenhäusern in Deutschland, denen aufgrund einer bakteriellen Infektion nicht mehr geholfen werden kann. In den meisten Fällen handelt es sich hierbei um multimorbide ältere Patienten oder um welche, die aus dem Ausland – vor allem aus dem asiatischen Raum – nach Deutschland kommen. Bei diesen Betroffenen ist der Behandlungserfolg heutzutage nicht mehr automatisch gegeben – teilweise ist das vor zehn bis zwanzig Jahren noch anders gewesen. Im natürlichen Wettlauf gegen die Bakterien muss daher vor allem auch die Qualifizierung des medizinischen Personals verbessert werden: Neben der Implementierung des Facharztes für Innere Medizin und Infektiologie sowie der Öffnung und Stärkung der zwölfmonatigen Zusatzweiterbildung Infektiologie für alle patientennahen und klinischen Fächer, spielen im Klinikalltag heutzutage antibiotikabeauftragte Ärzte eine größere Rolle in der Entscheidungsfindung, wann welche Medikamente verordnet werden. An diesem Punkt setzen auch diverse Projekte an, um Ärztinnen und Ärzte zu sensibilisieren und zu schulen. „Wichtig ist, dass diese Antibiotika nur verschreiben, wenn es medizinisch wirklich angezeigt ist. Zu oft, setzt sich noch das Motto lieber ein Antibiotikum zu viel als zu wenig durch, weil das medizinische Personal verständlicherweise will, dass es den Patienten besser geht. Sie denken aber nicht oft genug an die negativen Folgen, die diese Entscheidung haben kann. Wir müssen noch besser werden“, sagt Prof. Lemmen.
Verordnungsraten sinken in Deutschland
Die Summe aller Maßnahmen zeigt bereits wichtige Erfolge: Die Verordnungsraten sinken seit Jahren kontinuierlich. Waren es im Jahr 2000 noch 48,9 Millionen Antibiotikaverordnungen in Deutschland, sank die Zahl 2019 auf 34, 1 Millionen und im Jahr 2021 sogar auf 24,5 Millionen. Der Anteil verschriebener Reserveantibiotika sank von 66 Prozent im Jahr 2011 auf 48,6 Prozent im Jahr 2021. Als sogenannte Reserveantibiotika werden häufig neu entwickelte Antibiotika eingesetzt. Sie sollen so selten wie möglich verschrieben und nur unter strenger Indikation zur Patientenbehandlung eingesetzt werden, damit auch zukünftig weiterhin wirksame Medikamente in der Behandlung bakterieller Infektionen zur Verfügung stehen. Laut Prof. Lemmen wäre eine noch stärkere Reduzierung der Nutzung aller Antibiotika möglich, wenn sich ein anderes Vorgehen innerhalb der Behandlung etablieren würde: „Der beste Weg einer Verschreibung ist, dass der Erreger und seine Empfindlichkeit vorab im Labor bestimmt werden, damit man ihn anschließend mit dem optimalen Antibiotikum bekämpfen kann. Das dauert aber natürlich vorab einige Tage, bis die Laborergebnisse den behandelnden Ärzten zur Verfügung stehen. So lange können die Ärzte mit der Therapie natürlich nicht immer warten. In solchen Fällen sollten sie mit einer breiten Therapie beginnen, aber unbedingt mit spezifischeren Antibiotika nachsteuern, sobald die Ergebnisse vorliegen.“ Doch insbesondere im ambulanten Bereich ist dieses Vorgehen nicht der Standard und die Umsetzung komplex – hier ist der Gesetzgeber gefragt nachzusteuern.
Fehlende finanzielle Anreize für Pharmafirmen
Viele der großen Pharmaunternehmen haben sich mittlerweile aus der Entwicklung neuer Antibiotika zurückgezogen. Der Grund hierfür liegt in dem existierenden Vergütungssystem: Die entwickelten Reserveantibiotika sollen möglichst selten in der medizinischen Behandlung eingesetzt werden. Die Vergütung erfolgt aber nach dem Volumen. Pharmaunternehmen haben also aus wirtschaftlichen Aspekten ein Interesse daran, Medikamente zu entwickeln, die möglichst viel eingesetzt und abgerechnet werden können. Die Entwicklung von Reserveantibiotika ist daher wenig attraktiv. Mit der Verabschiedung des Arzneimittel-Versorgungsstärkungsgesetz (AMVSG) im Jahr 2017 und des Fairer-Kassenwettbewerb-Gesetzes (GKV-FKG) im Jahr 2020 hat der Gesetzgeber Maßnahmen ergriffen, um diesem Trend entgegenzuwirken. Das AMVSG erlaubt seitdem, dass Reserveantibiotika bei der Bildung von Festbetragsgruppen für Antibiotika berücksichtig werden können – sie werden seither davon ausgenommen.
Doch die Probleme bleiben: Gerade kleinere, mittelständische Unternehmen stemmen vorwiegend die Entwicklung neuer Antibiotika. Zwar berichten diese Unternehmer, dass die Forschungsförderung in Deutschland grundsätzlich gut funktioniere, aber die Finanzierung der klinischen Studien sei deutlich schwieriger. Kleinere Unternehmen könnten das oft nicht leisten und seien dann doch wieder auf Kooperationen mit größeren pharmazeutischen Unternehmen angewiesen. Der Anreiz für die Zusammenarbeit besteht bei Ihnen aber weiterhin nur, wenn die Erträge die Kosten übersteigen – dazu muss die Politik das derzeitige System reformieren. Die zur Debatte stehende Idee ist, dass man die Vergütung von Reserveantibiotika nicht mehr an das Volumen koppelt. Eine Lösung, die auch in einem Pilotprojekt in Großbritannien erprobt wird, ist dass der Staat beziehungsweise eine Staatengemeinschaft einen fixen Betrag an Pharmaunternehmen zahlt und diese im Gegenzug ein bestimmtes Reserveantibiotikum, dessen Wirksamkeit erwiesen ist, für alle Menschen in einem definierten Bereich zur Verfügung stellen. Diese Medikamente dürften dann wiederum nur von Infektiologen in ausgewiesenen Zentren verordnet werden, um die Entwicklung neuer Resistenzen zu minimieren und den Vorsprung gegenüber den Bakterien im Wettlauf gegen die Evolution nicht zu verlieren. Ob Ideen wie diese Teil einer Lösung sind, wird sich zeigen. Fest steht nur, dass aus globaler Perspektive das Problem antimikrobiellen Resistenzen immer größer und nicht kleiner wird.